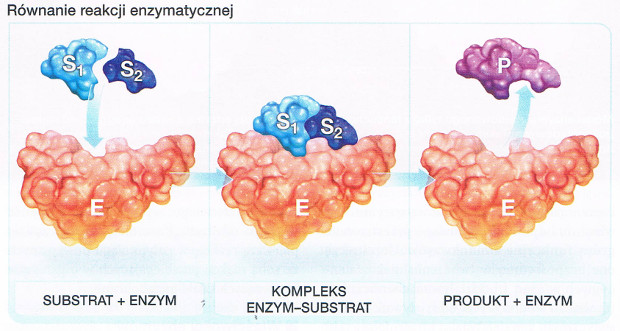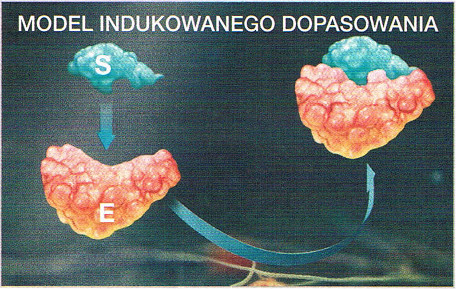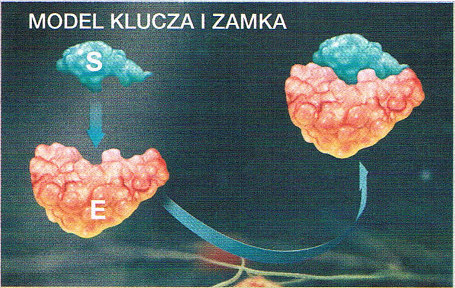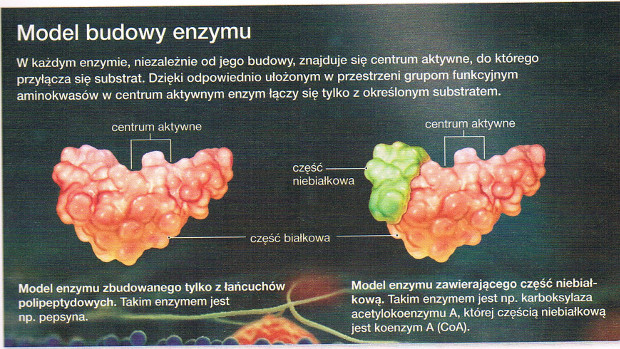
| BUDOWA ENZYMU ZAWIERAJĄCEGO CZĘŚĆ NIEBIAŁKOWĄ | |||
| Część białkoą (apoenzym) | Część niebiałkowa (kofaktor) | ||
| jony metali, np. żelaza, miedzi, cynku, magnezu | grupa prostetyczna - mała cząsteczka organiczna trwale związana z enzymem, np. pochodna wit. B1, w dehydrogenazie pirogranowej | koenzym - mała cząsteczka organiczna nietrwale związana z enzymem, np. koenzym A, witaminy, NAD+, FAD | |