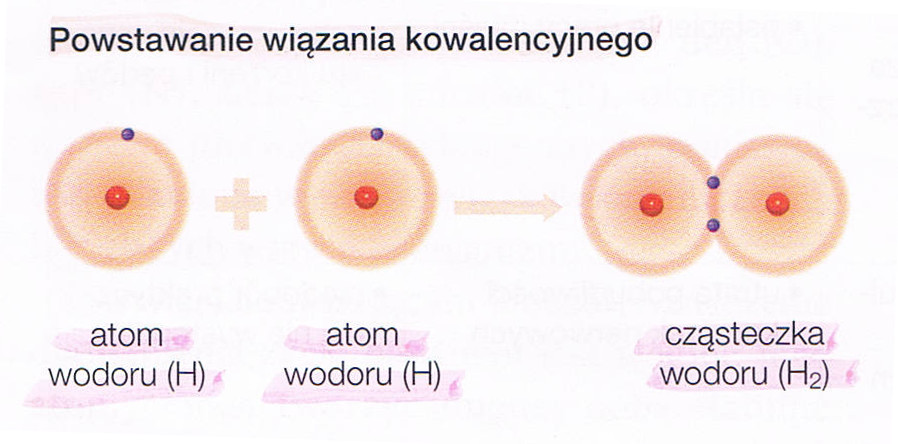
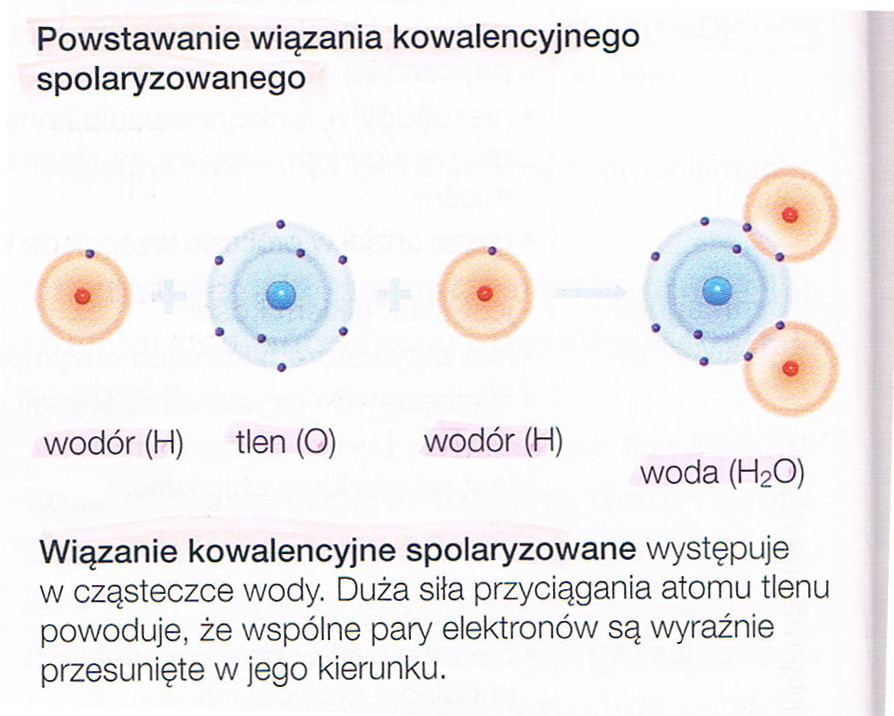
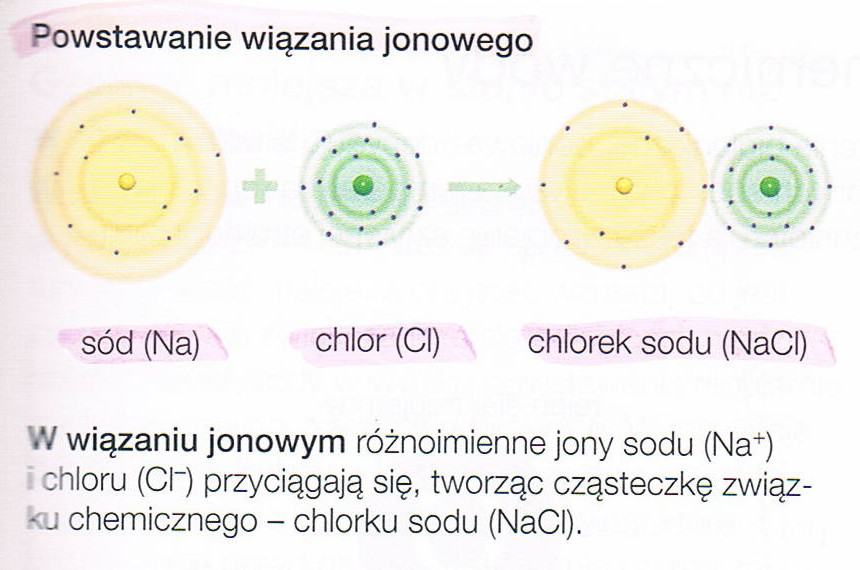
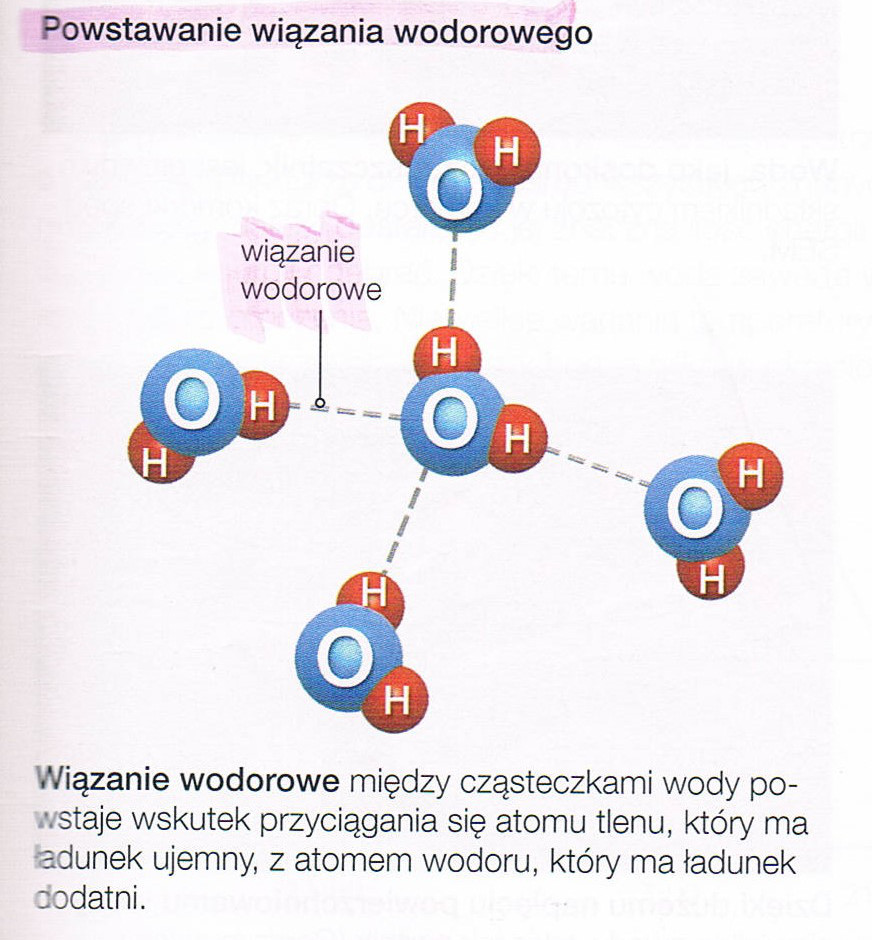
| SKŁADNIKI CHEMICZNE ORGANIZMÓ | |
|---|---|
| Pierwiastki | |
| makroelementy | mikroelementy |
|
|
| związki nieorganiczne | zaiązki organiczne |
| woda, sole mineralne | węglowodany, lipidy, białka, kwasy nukleinowe |
| Pierwiastek i forma jego występowania |
Niektóre funkcje biologiczne | Przykładowe objawy niedoboru | ||
|---|---|---|---|---|
| M A K R O E L E M E N T Y |
Wapń Ca2+ |
|
|
|
| Magnez (Mg2+) |
|
|
|
|
| Potas (K+) |
|
|
|
|