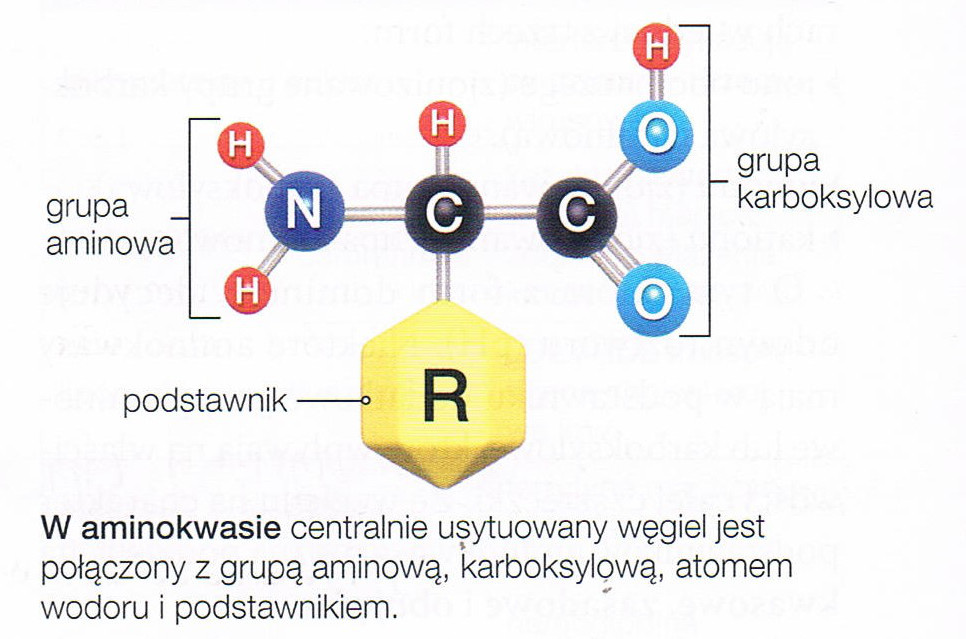
W skłąd białek wchodzą wyłącznie L-aminokwasy.
Aminokwasy mogą występować w roztworach w jednej z trzech form:
- jonu obojniaczego (zjonizowane grupy karboksylowa i aminow),
- anionu (zjonizowana grupa karboksylowa),
- kationu (zjonizowana grupa aminowa).
O tym, która z form dominuje, decyduje odczyn roztworu(pH).
Ze względu na charakter podstawników aminokwasy można podzielić na kwasowe, zasadowe i obojętne.

Wszystkie białka zbudowane z 20 rodzajów aminokwasów, które łączą się ze sobą wiązaniami peptydowymi. W powstaniu tych wiąza uczestniczy grupa karboksylowa jednego z amiokwasu oraz grupa aminowa drugiego aminowasu. W zależności od liczby aminokwasów w łańcuchi wyróżnia się umownie:
- oligopeptydy, zawierające 2-10 aminokwasów,
- polipeptydy, zawierające 11-100 aminokwasów
- makropeptydy (białak), zawierające więcej niż 100 aminokwasów w łańcuchu.
Oligopeptydami są np. wazopresyna i oksytocyna, hormony wytwarzane w tylnym płacie przysadki mózgowej. Do polipeptydów należy min. insulina - hormon wytwarzany przez komórki trzustki, wpływający na utrzymanie właściwego stężenia glukozy we krwi. Natomiast makropeptydem jest np. albumina, białko osocza krwi uczestniczące min. w regulacji ciśnienia osmotycznego krwi.

| PODZIAŁ AMINOKWASÓW ZE WZGLĘDU NA CHARAKTER PODSTAWKI | |||
|---|---|---|---|
| kwasowe (przewaga grup karboksylowych) | zasadowe (przewaga grup aminowych) | obojętne (jednakowa liczba obu grup) | |
|
|
polarne:
|
niepolarne:
|
Budowa i rodzaje białek
Białka dzieli się na dwie duże grupy : białak fibrylarne (włókienkowe) i białak globularne. Białka fibrylarne mają strukturę włóknistą i nie rozpuszczają się w wodzie, dlatego przede wszystkim wchodzą w skład elementów strukturalnych organizmów.Białka globularne mają kształt kulisty, zazwyczaj rozpuszczaja sie w wodzie lub wodnych roztworach kwasów, zasad oraz soli. Pełnią funkcję, m.in. są enzymami, hormonami, uczestniczą w transporcie, stanowią materiał zapasowy. Do białek globulinowych należą m.in.:
- albuminy - są to rozpuszczalne w wodzie składniki osocza krwi odpowiedzialne m.in. za transport kwasów tłuszczowych i niektórych hormonów oraz za regulację ciśnienia osmotycznego krwi. Mają działanie buforujące.
- globuliny - odpowiadają m.in. za odporność organizmu (przeciwciała) oraz transport hormonów steroidowych;
- histony - występują w jądrze komórkowym, gdzie wraz z DNA tworzą chromatynę.
Ze względu na brak lub obecność w cząsteczce elementów nieaminkowasowych, związanych kowalnecyjnie lub w inny sposób, białka dzieli się na proste i złożone. Bialka proste zbudowane tylko z aminokwasów, a w śród buałek złożonych w zalezności od części niebiałkowej wyróżnia się: glikoproteiny, fosfoproteiny, lipoproteiny, metaloproteiny, hemoproteiny.
Właściowści białek
Większośc buałek rozpuszcza się w wodzie, towrząc koloid, czyli mieszaninę, w której jedna substancja (w tym wypadku białko) jest rozproszona w drugiej (w tym wypadku woda). Wodny roztwór białka to zod. Po dodaniu do niego soli metali lekkich, np. NaCl, zachodzi koagulacja białka. Z zolu powstaje żel. Koagulacja jest procesem odwracalnym - żel rozpuszcza się i przechodzi ponownie w zol po dodaniu wody. Do nieodwracalnej zmiany struktury dochodzi podczas denaturacji, dochodzi do niej pod wpływem czynników fizycznych(np temperatury powyżej 40oC) lub chemicznych (np stężonych kwasów i zasad, kationów metali ciężkih). Skutkiem tego procesu jest zerwanie wiązań stabilizujących przez białka właściwości biologicznych i fizykochemicznych.Struktura białek
Wiązania peptydowe między kolejnymi aminokwasami w łańcuchu polipeptydowych są sztywne. Jednak woków pozostałych wiązań łańcuch może się swobodnie obracać. Dzięki temu cząsteczki białek przyjmują różne formy przestrzenne.Struktura pierwszorzędowa
Strukturę pierwszorzedową wyznacza kolejność aminokwasów w łańcuchu peptydowym.
Struktura drugorzędowa
Strukturę drugorzędową stanowią łańcuchy polipeptydowe tworzące strukturę α-helisy i β-harmonijki. Powstaje ona na skutek wytworzenia wiązań wodorowych między grupą aminową wchodzącą w skład jednego wiązania peptydowego a grupą karboksylową innego wizania peptydowego aminokwasąw znajdujących się blisko siebie w łańcuchu polipeptydowym. Strukturu α-helisy i β-harmonijki czasem nie obejmują całego łańcucha polipeptydowego.
Darmowy hosting zapewnia PRV.PL